De bloed-hersenbarrière
- 00 — Inleiding
- 01 — Anatomie en fysiologie van de BHB
- 02 — Verstoring van de BHB
- 03 — Gevolgen van BHB-verstoring
- 04 — Behandeling van BHB-verstoring
- 05 — Conclusie
- 06 — Reacties (0)
De bloed-hersenbarrière (BHB) is een van de belangrijkste mechanismen voor regulatie en behoud van de cerebrale homeostase en hiermee de hersenfunctie. Acute ziektebeelden die leiden tot verstoring van de BHB zijn onder andere CVA’s, insulten, systemische inflammatie en neurotraumata. Chronische ziektebeelden die geassocieerd zijn met een verstoring van de BHB zijn neurodegeneratieve ziekten zoals de ziekte van Parkinson en ziekte van Alzheimer, epilepsie en primaire neurologische tumoren. Bij patiënten met een verhoogd risico op verstoring van de BHB moet men bedacht zijn op klinische consequenties zoals cerebraal oedeem en neuro-inflammatie, en farmacologische consequenties zoals neurotoxiciteit.
Een 68-jarige man, bekend met de ziekte van Parkinson met nog goede actieradius, wordt op de IC opgenomen na een geïsoleerd neurotrauma na een val van de trap. De initiële EMV-score is E3M6V4, maar op de SEH verslechtert hij acuut naar een E1M4V1 met een wijde lichtstijve pupil links, waarop hij na ‘rapid sequence induction’ wordt geïntubeerd. CT-cerebrum toont enkele contusiehaarden en een acuut subduraal hematoom met enige massawerking waarvoor spoeddecompressie-hemicraniotomie. Postoperatief wordt hij op de IC opgenomen. De anisocorie is hersteld, maar zijn pupillen zijn, ondanks normale grootte, niet lichtreactief. Controle-CT-cerebrum laat een verbeterd postoperatief beeld zien zonder massawerking. De pupilreacties herstellen enkele uren later spontaan. Na staken van de propofol en remifentanyl scoort hij maximaal een E3M5Vt. Enkele dagen na staken van de sedatie ontwikkelt hij een gegeneraliseerd insult, waarop gestart wordt met een midazolamperfusor naast anti-epileptica. Twaalf uur na de infusie is er geen epilepsie meer en wordt de midazolam gestaakt. Hoewel de nierfunctie goed is gebleven, is hij twee dagen na het staken van de sedatie nog niet wakker (E1M1V1). CT-cerebrum toont geen verklaring. U denkt aan een midazolamintoxicatie en besluit derhalve nog af te wachten; antagoneren acht u immers onverstandig gezien het recente insult. De volgende dag verbetert de EMV-score. Later in het beloop kan patiënt gedetubeerd worden, maar hij is erg motorisch onrustig. U denkt aan een delier. Naast niet-medicamenteuze maatregelen start u met quetiapine. Enkele dagen later kan patiënt in klinisch verbeterde conditie ontslagen worden naar de afdeling. Gezien de pre-existente morbiditeit van patiënt en het beloop van de opname uit u in uw overdracht aan het ontvangend specialisme uw zorgen met betrekking tot de kwetsbaarheid van het brein van deze patiënt.
De hersenen worden door een aantal verschillende hersenbarrières beschermd voor schade van buitenaf. De belangrijkste hersenbarrière is de bloed-hersenbarrière (BHB). In dit artikel leert u de anatomische en fysiologische principes van de BHB kennen. U krijgt inzicht in de functionele veranderingen van de BHB tijdens acute ziekte en trauma, leert risicogroepen te herkennen, en maakt kennis met de klinische en farmacologische consequenties van een verstoring van de BHB.
De aanwezigheid van een fysieke barrière tussen de hersenen en de rest van het lichaam werd in 1885 voor het eerst beschreven door Paul Erlich.Ehrlich P. Das Sauerstoff-Bedürfniss des Organismus. Eine Farbenanalytische Studie. Berlin: August Hirschwald; 1885. Hij injecteerde intraveneus een kleurstof in muizen en observeerde dat de perifere organen wel aankleurden, maar de hersenen en het ruggenmerg niet. Daarna heeft zijn student Edwin Goldman aangetoond dat directe injectie van een kleurstof in de liquor louter tot aankleuring van het centraal zenuwstelsel leidde, maar niet tot aankleuring van de overige organen.Goldmann EE. Vitalfärbung am Zentralnervensystem: Beitrag zur Physio-Pathologie des Plexus chorioideus und der Hirnhäute. Berlin: Königl. Akademie der Wissenschaften, 1913. Zij concludeerden dat er een afscheiding tussen de bloedbaan en het centraal zenuwstelsel moest zijn: de bloed-hersenbarrière.
De bloed-hersenbarrière is een fysiologische interface die nagenoeg alle haarvaten in de hersenen omgeeft (figuur 1a). Hij scheidt de cerebrale circulatie van het extracellulaire compartiment van het centraal zenuwstelsel (CZS), waardoor homeostase in de hersenen nauwgezet gereguleerd kan worden. Het ruggenmerg heeft, hoewel het morfologisch en functioneel verschillend is, een soortgelijke interface.Bartanusz V, Jezova D, Alajajian B, et al. The blood-spinal cord barrier: morphology and clinical implications.
Slechts enkele delen van de hersenen hebben geen BHB; dat zijn de circumventriculaire organen, zoals de neurohypofyse en de epifyse. Omdat deze organen bij de regulatie van het autonome zenuwstelsel en hormonale processen betrokken zijn, hebben zij een directe connectie met de circulatie.Ganong WF. Circumventricular organs: Definition and role in the regulation of endocrine and autonomic function. Clin Exp Pharmacol Physiol 2000; 27(5-6): 422–27. De plexus choreoideus, verantwoordelijk voor de aanmaak van liquor, heeft ook geen BHB; zijn eigen epitheelcellen vormen tight junctions om eenzelfde effect te bewerkstelligen.Marques F, Sousa JC, Brito MA, et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiol Dis 2017; 107: 32-40. Dit is de bloed-liquorbarrière (BCSFB) (figuur 1b). De buitenzijde van de hersenen wordt omvat door de arachnoïdale barrière, gelegen onder de dura (figuur 1c). Deze barrière heeft, behalve als fysieke barrière, geen significante bijdrage aan de regulatie van de cerebrale homeostase.
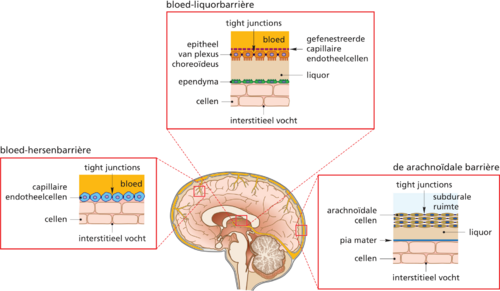
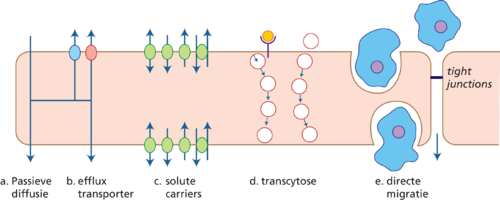
De BHB heeft de belangrijkste rol in het behoud van en de regulatie van de cerebrale homeostase. Zij wordt gevormd doordat de endotheelcellen van de bloedvaten van het CZS nauw tegen elkaar gelegen zijn, de zogeheten tight junctions. Endotheelcellen van bloedvaten elders in het lichaam hebben daarentegen fenestraties, waardoor stoffen zich vrij kunnen verplaatsen tussen bloed en de extracellulaire ruimte. Ook sluiten de voeten van de astrocyten (glia limitans) naadloos aan in de BHB. De combinatie van deze tight junctions en glia limitans zorgt ervoor dat moleculen niet vrij kunnen passeren. Wel zijn zij permeabel voor gassen. Lipofiele moleculen kunnen de barrière passeren door middel van passieve diffusie (figuur 2a), en slechts enkele mononucleaire immuuncellen (mononuclaire leukocyten, monocyten en macrofagen) kunnen direct via de BHB migreren (figuur 2e). Voor passage van overige moleculen is daarentegen actief transport noodzakelijk.
Actief transport door de BHB gaat voornamelijk via transporters, maar ook via transcytose. Transporters kunnen ingedeeld worden in effluxtransporters (figuur 2B) en solute carriers (figuur 2c), en zijn van belang voor het transport van essentiële nutriënten en medicatie.
Effluxtransporters, hoofdzakelijk gelegen aan de luminale zijde (bloedzijde), transporteren kleine moleculen terug de bloedbaan in. Zo kunnen zij ook lipofiele stoffen die via diffusie zijn binnengekomen onderscheppen. De belangrijkste effluxtransporter is P-glycoproteïne (Pgp).
Solute carriers, gelegen aan zowel de luminale als de abluminale (hersen)zijde, zijn verantwoordelijk voor het transport van meer hydrofiele moleculen, waaronder glucose, lactaat, aminozuren en vetzuren. Transport kan bidirectioneel zijn. Solutecarriers zijn derhalve van vitaal belang voor de energievoorziening van de hersenen.
Macromoleculen kunnen door middel van transcytose de BHB passeren (figuur 2d). Transcytose is een vorm van transcellulair transport, waarbij vesikels gevormd worden waarin de moleculen intact vervoerd kunnen worden door de cel heen. Voorbeelden van moleculen die met behulp van transcytose de hersenen bereiken zijn insuline, transferrine, IgG en tumornecrosefactor alfa (TNF-α).
Onder normale fysiologische condities is de BHB nagenoeg ondoordringbaar. Wanneer echter verstoring van de BHB optreedt, ontstaat ongereguleerde flux van moleculen. Deze verstoring kan disruptief zijn (gedefinieerd als anatomische veranderingen op histologisch niveau zoals endotheelschade) of niet-disruptief (gedefinieerd als fysiologische veranderingen op moleculair niveau).Varatharaj A, Galea I. The blood-brain barrier in systemic inflammation. Brain Behav Immun [Internet] 2017; 60: 1-12. http://dx.doi.org/10.1016/j.bbi.2016.03.010. Beide leiden tot disregulatie van ionen en neurotransmitters, lekkage van plasma-eiwitten, toegang van toxinen en pathogenen, en het vrijkomen van cytokinen. Ook heeft het farmacodynamische consequenties, met toegenomen exposure van medicamenten aan de hersenen en het hiermee toegenomen risico op toxiciteit. Uiteindelijk treedt neuronale disfunctie, inflammatie en hersendegradatie op.
Er zijn momenteel nog geen geschikte biomarkers die verstoring van de BHB kunnen aangeven, hoewel neuron-specific enolase (NSE) en S100B mogelijk in de toekomst een rol zullen spelen.Pardridge WM. Drug transport across the blood-brain barrier. J Cereb Blood Flow Metab 2012; 32(11): 1959-72. Beeldvorming met MRI kan helpen in de diagnostiek, maar is klinisch van weinig toegevoegde waarde. Het is derhalve van belang dat de clinicus beseft welke pathologie kan leiden tot verstoring van de BHB en welke klinische consequenties dit zou kunnen hebben. In deze review wordt de nadruk gelegd op de ziektebeelden die op de IC gezien kunnen worden.
Ischemie van het brein leidt tot schade ten gevolge van verminderde toevoer van zuurstof en voedingsstoffen. Vroege reperfusie kan schade beperken, maar gaat wel gepaard met oxidatieve stress. Vrije zuurstofradicalen zorgen voor een disruptieve verstoring van de BHB ten gevolge van direct cytotoxisch effect met eiwit-, lipiden- en DNA-degradatie tot gevolg en verlies van tight junctions en voor een niet-disruptieve verstoring van de BHB ten gevolge van upregulatie van inflammatoire mediatoren.Kadry H, Noorani B, Cucullo L. A blood-brain barrier overview on structure, function, impairment, and biomarkers of integrity. Fluids Barriers CNS [Internet] 2020; 17(1): 1-24. https://doi.org/10.1186/s12987-020-00230-3. De klinische relevantie van deze verstoring van de BHB is nog niet volledig opgehelderd, hoewel de kwetsbaarheid van het brein in de acute fase wellicht hieraan kan worden toegeschreven.
Ook intracraniële bloedingen kunnen leiden tot verstoring van de BHB.Keep RF, Zhou N, Xiang J, et al. Vascular disruption and blood-brain barrier dysfunction in intracerebral hemorrhage. Fluids Barriers CNS 2014; 11(1): 1-13. Er heeft immers een ruptuur plaatsgevonden in een vaatwand, waardoor lokaal de BHB reeds beschadigd is. Er treedt echter ook secundaire schade op ten gevolge van lokale hypoxie zoals bij een ischemisch CVA, ten gevolge van vrijgekomen bloedcomponenten, en in latere fase ten gevolge van verhoogde intracraniële druk. Er zijn aanwijzingen dat bij hypertensieve intraparenchymateuze bloedingen toegenomen BHB-permeabiliteit reeds enkele uren voor de bloeding optreedt, hetgeen suggereert dat de integriteit van de vaatwand geleidelijk afneemt.Lee JM, Zhai G, Liu Q, et al. Vascular permeability precedes spontaneous intracerebral hemorrhage in stroke-prone spontaneously hypertensive rats. Stroke 2007; 38(12): 3289-91. Het vrijgekomen bloed zorgt zelf ook voor een verstoring van de BHB. Belangrijke bijdragende bloedcomponenten zijn cytokinen, trombine en fibrine, en componenten van hemolyse als heem en bilirubine, die alle leiden tot lokale inflammatie en hiermee toegenomen permeabiliteit van de BHB.
Tijdens systemische inflammatie spelen prostanoïden en stikstofoxide een centrale rol in de degradatie van tight junctions. Ook komen zuurstofradicalen vrij, die een direct cytotoxisch effect hebben op het endotheel. Systemische inflammatie leidt echter met name tot niet-disruptieve veranderingen van de BHB, wat een mate van reversibiliteit impliceert.Varatharaj A, Galea I. The blood-brain barrier in systemic inflammation. Brain Behav Immun [Internet] 2017; 60: 1-12. http://dx.doi.org/10.1016/j.bbi.2016.03.010. Tijdens systemische inflammatie ontstaat downregulatie van transporters, waaronder P-glycoproteïne. Daarentegen ontstaat upregulatie van transcytose, wat leidt tot influx van onder andere insuline, TNF-α en andere cytokinen. Deze systemische inflammatie zorgt dus voor degradatie van de BHB, met neuro-inflammatie tot gevolg. Daarnaast zijn er bescheiden aanwijzingen dat verstoring van de BHB kan leiden tot neuro-invasie van (virale) pathogenen.Najjar S, Najjar A, Chong DJ, et al. Central nervous system complications associated with SARS-CoV-2 infection: integrative concepts of pathophysiology and case reports. J Neuroinflammation 2020; 17(1): 1-14.
Dahm T, Rudolph H, Schwerk C, et al. Neuroinvasion and inflammation in viral central nervous system infections. Mediators Inflamm 2016; 2016: 8562805.
CZS-infecties (zoals meningitis en encefalitis) doen vermoeden dat de BHB reeds ernstig verstoord is, maar dat hoeft niet zo te zijn. Bacteriële invasie kan geschieden door disruptie van tight junctions, maar ook door transcytose of door een ‘Trojan horse’ via geïnfecteerde leukocyten.Cain MD, Salimi H, Diamond MS, et al. Mechanisms of pathogen invasion into the central nervous system. Neuron [Internet] 2019; 103(5): 771-83. https://doi.org/10.1016/j.neuron.2019.07.015.
Kim KS. Investigating bacterial penetration of the blood-brain barrier for the pathogenesis, prevention, and therapy of bacterial meningitis. ACS Infect Dis 2020; 6(1): 34-42.
De BHB wordt vervolgens van binnenuit verstoord via lokale inflammatie van het CZS, waardoor vervolgens dezelfde effecten optreden als bij systemische inflammatie en neuro-inflammatie.
De relatie tussen epilepsie en BHB-disfunctie is beter onderzocht. MRI-studies laten zien dat zowel focale als gegeneraliseerde insulten leiden tot contrastlekkage en dus tot verstoring van de BHB.Rüber T, David B, Lüchters G, et al. Evidence for peri-ictal blood-brain barrier dysfunction in patients with epilepsy. Brain 2018; 141(10): 2952-65. De pathogenese is multifactorieel. Bij epilepsie treedt aberrante cerebrovasculaire angiogenese op, wat geassocieerd is met verlies van tight junctions. De morfologische en functionele verandering van astrocyten leiden tot gewijzigde expressie van kalium- en waterkanalen, wat ook geassocieerd is met verandering van BHB-functie. Tijdens insulten ontstaat een verhoging van het cerebraal glutamaat, waardoor de expressie van matrix-metalloproteïnasen (MMP’s) toeneemt. MMP’s remodelleren de extracellulaire matrix en breken junctionele componenten van de BHB af, waardoor upregulatie leidt tot verstoring van de BHB. Dit leidt tot toename van cytokinen en dus tot neuro-inflammatie met dientengevolge verdere BHB-verstoring. Ook zijn er aanwijzingen dat verstoring van de BHB zelf kan leiden tot epileptische insulten.Marchi N, Angelov L, Masaryk T, et al. Seizure-promoting effect of blood-brain barrier disruption. Epilepsia 2007; 48(4): 732-42. Hierdoor ontstaat een positieve feedbackloop met een zelfversterkend effect. Epilepsie is dus zowel een trigger als een consequentie van verstoring van de BHB.
Therapieresistentie heeft mogelijk te maken met BHB-disfunctie. Therapeutische strategieën waarbij anti-epileptica direct in het CZS geïnjecteerd worden, waardoor de BHB omzeild wordt, zijn in ontwikkeling.
Bij neurotraumata is in de vroege fase sprake van disruptieve verstoring van de BHB, vooral ten gevolge van verlies van tight junctions. Extravasatie van proteïnen naar het CZS is echter ook gezien bij patiënten jaren na het trauma, wat doet vermoeden dat deze disruptieve verstoring niet (volledig) reversibel is.Hay JR, Johnson VE, Young AMH, et al. Blood-brain barrier disruption is an early event that may persist for many years after traumatic brain injury in humans. J Neuropathol Exp Neurol [Internet] 2015 [cited 2021 Nov 18]; 74(12): 1147-57. https://pubmed-ncbi-nlm-nih-gov.ru.idm.oclc.org/26574669/. Verstoring van de BHB ontstaat in eerste instantie door directe beschadiging ten gevolge van het trauma. In de vroege fase ontstaat vervolgens neuro-inflammatie door de vrijgekomen bloedcomponenten met hierdoor secundaire schade aan de BHB. In latere fase ontstaat eveneens schade als gevolg van cerebraal oedeem en verhoogde intracraniële druk.Cash A, Theus MH. Mechanisms of blood-brain barrier dysfunction in traumatic brain injury. Int J Mol Sci 2020; 21(9): 3344.
Verschillende neurodegeneratieve ziekten zijn geassocieerd met verstoring van de BHB, waaronder de ziekte van Alzheimer, de ziekte van Parkinson, multipele sclerose (MS) en primaire hersentumoren.Sweeney MD, Zhao Z, Montagne A, et al. Blood-brain barrier: from physiology to disease and back. Physiol Rev [Internet] 2019 Jan 1 [cited 2021 Nov 18]; 99(1): 21-78. https://pubmed-ncbi-nlm-nih-gov.ru.idm.oclc.org/30280653/.
Bij de ziekte van Alzheimer staan amyoïddeposities centraal in de pathofysiologie. Amyloïddeposities leiden tot neoangiogenese en lokale hypervascularisatie waardoor er redistributie van tight junctions ontstaat, met BHB-verstoring tot gevolg. De cytokines die hierbij vrijkomen leiden vervolgens tot neuro-inflammatie.
Bij de ziekte van Parkinson is het onderliggend mechanisme nog niet goed opgehelderd. Mutaties in leucinerijk repeat-kinase 2 leiden tot endotheeldisfunctie en hiermee tot verlies van integriteit van de vaatwand. Daarnaast is parkinson geassocieerd met verminderde expressie van P-glycoproteïne (P-gp), wat tot BHB-verstoring leidt.Bartels AL, Willemsen ATM, Kortekaas R, et al. Decreased blood-brain barrier P-glycoprotein function in the progression of Parkinson’s disease, PSP and MSA. J Neural Transm 2008; 115(7): 1001-9.
Bij MS is BHB-disfunctie een belangrijke eigenschap en is derhalve het meeste onderzocht.Minagar A, Alexander JS. Blood-brain barrier disruption in multiple sclerosis. Mult Scler 2003; 9(6): 540-9. Contrast-MRI-studies laten lekkage zien bij het ontstaan van nieuwe laesies. Waarschijnlijk ligt auto-immuun gemedieerde neuro-inflammatie hieraan ten grondslag met influx van cytokinen, leukocyten en oxidatieve stressoren. Daarnaast is bij MS de integriteit van de tight junctions verstoord ten gevolge van toegenomen productie van verschillende MMP’s.
Primaire hersentumoren leiden tot lokale verstoring van de BHB, wat in de literatuur beschreven wordt als de brain-tumorbarrière (BTB). De BTB wordt gekenmerkt door niet-uniforme permeabiliteit en actieve efflux van moleculen.Arvanitis CD, Ferraro GB, Jain RK. The blood-brain barrier and blood-tumour barrier in brain tumours and metastases. Nat Rev Cancer [Internet] 2020; 20(1): 26-41. http://dx.doi.org/10.1038/s41568-019-0205-x. Dit fenomeen treedt ook op bij afstandsmetastasen in de hersenen. Aangezien er lokale verstoring is, zijn er ontwikkelingen om deze eigenschap farmacologisch te exploiteren middels targeted therapy. Daarnaast moet men erop bedacht zijn dat radiotherapie als behandeling van hersentumoren leidt tot neuro-inflammatie en derhalve een algehele verstoring van de BHB.
Combinaties van ziektebeelden die gepaard gaan met verstoring van de BHB versterken het effect en dus ook de klinische consequenties.
De belangrijkste klinische consequenties van verstoring van de BHB zijn de ontwikkeling van cerebraal oedeem en neuro-inflammatie. Beide leiden tot schade aan de BHB zelf, met hierbij amplificatie van het effect, en aan de hersenen.
Cerebraal oedeem ontstaat ten gevolge van accumulatie van water in de hersenen. Vasogeen oedeem is een direct gevolg van endotheelschade en leidt tot toename van water in het extracellulaire compartiment. Daarentegen ontstaat ook intracellulair toename van water (cytotoxisch oedeem) door activatie van ionkanalen. Cytotoxisch oedeem ontstaat meestal binnen enkele uren na de ictus. Upregulatie van natrium-kaliumchloride-cotransporters (NKCC1) en aquaporinekanalen, met name AQ4, ligt hieraan ten grondslag. Vasogeen oedeem ontstaat pas enkele dagen later. Het wordt hoofdzakelijk gemedieerd door VEGF (vascular endothelial growth factor), die de permeabiliteit van de BHB vergroot. Beide leiden tot toename van intracraniële druk, en hiermee tot toename van schade aan zowel hersenen als de BHB zelf, waardoor verdere schade wordt geïnduceerd.
Neuro-inflammatie ontstaat doordat vasoactieve en chemotactische cytokinen de hersenen kunnen binnentreden. Vasoactieve cytokinen kunnen bijdragen aan de vorming van cerebraal oedeem. Chemotactische cytokinen versterken de inflammatoire respons. Dit leidt tot activatie van astrocyten en microglia, waardoor de inflammatoire cascade nog verder versterkt wordt.
Microglia zijn de macrofagen van het CZS en spelen derhalve een belangrijke rol in inflammatie en herstel na schade. Activatie van microglia volgt twee specifieke pathways, de pro-inflammatoire M1-pathway en de anti-inflammatoire M2-pathway. In de pro-inflammatoire M1-fase worden onder andere interleukine (IL)-1, TNF-α, stikstofoxide en zuurstofradicalen geproduceerd, met afbraak van de BHB tot gevolg. De anti-inflammatoire M2-fase wordt geactiveerd via IL-4 en wordt gekenmerkt door productie van onder andere IL-10. De M2-fase treedt echter pas in een latere fase op dan de M1 fase. De effecten van neuro-inflammatie worden bovendien versterkt bij patiënten met een onderliggend ziektebeeld dat reeds geassocieerd is met een disruptief verstoorde BHB, zoals bij de ziekte van Alzheimer, bij primaire hersentumoren, na een CVA of na neurotrauma; het zogeheten ‘kwetsbaar brein’. Neuro-inflammatie is waarschijnlijk de oorzaak van het klinisch beeld dat bekend staat als septische encefalopathie of delier.Banks WA. Blood-brain barrier transport of cytokines: a mechanism for neuropathology. Curr Pharm Des 2005; 11(8): 973-84.
Medicamenten kunnen op verschillende manieren het CZS binnenkomen. De belangrijkste hiervan is via de BCSFB, ofwel via de plexus choreoideus.Pardridge WM. Drug transport across the blood-brain barrier. J Cereb Blood Flow Metab 2012; 32(11): 1959-72.
Pardridge WM. CSF, blood-brain barrier, and brain drug delivery. Expert Opin Drug Deliv [Internet] 2016; 13(7): 963-75. http://dx.doi.org/10.1517/17425247.2016.1171315. Direct worden de meeste medicamenten via transporters teruggepompt naar het bloed. Ook kunnen medicamenten via de BHB de hersenen bereiken.
Transporters spelen in vitale rol in het bepalen van de mate van drug exposure in het CZS en daarmee de effecten van het medicament op het brein. Belangrijke farmacologische transporters van het CZS zijn onder andere P-glycoproteïne (P-gp), organic anion-transporting polypeptides 1A2 (OATP1A2/SLCO1A2), organic anion transporter 3 (OAT3), breast-cancer-resistance protein (BRCP/ABCG2) en multidrug-resistance-associated protein 4 (MRCP4/ABCC4).Urquhart BL, Kim RB. Blood-brain barrier transporters and response to CNS-active drugs. Eur J Clin Pharmacol [Internet] 2009 Nov [cited 2021 Nov 18]; 65(11): 1063-70. https://pubmed-ncbi-nlm-nih-gov.ru.idm.oclc.org/19727692/. Deze transporters bevinden zich (deels) ook op andere plaatsen in het lichaam, waaronder in de proximale tubulus van de nier, van belang voor actieve renale excretie en terugresorptie van medicamenten.
Veel medicamenten zijn substraten voor P-gp.Lin JH, Yamazaki M. Role of P-glycoprotein in pharmacokinetics. Clin Pharmacokinet 2003; 42(1): 59-98. P-gp is de belangrijkste effluxtransporter in de BHB. Dat wil zeggen dat deze transporter de hersenen zoveel mogelijk vrijhoudt van middelen als digoxine, midazolam,Tolle-Sander S, Rautio J, Wring S, et al. Midazolam exhibits characteristics of a highly permeable P-glycoprotein substrate. Pharm Res [Internet] 2003 [cited 2021 Nov 18]; 20(5): 757-64. https://pubmed.ncbi.nlm.nih.gov/12751631/. multipele opioïden waaronder morfine, buprenorfine, methadon, oxycodon en fentanyl,Chaves C, Remiao F, Cisternino S, et al. Opioids and the blood-brain barrier: a dynamic interaction with consequences on drug disposition in brain. Curr Neuropharmacol 2017; 15(8): 1156-73. en verschillende antiobiotica zoals tetracyclines, macroliden en chinolonen.Lin JH, Yamazaki M. Role of P-glycoprotein in pharmacokinetics. Clin Pharmacokinet 2003; 42(1): 59-98. Verstoring van de BHB en hiermee dus ook verstoring van P-gp kan dus leiden tot neurotoxiciteit van deze middelen. Indien er gecombineerd wordt met een P-gp-inhibitor, zoals amiodaron, macroliden zoals erytromycine of methadon, moet men bedacht zijn op toegenomen toxiciteit van het substraat.
Een ander voorbeeld is rocuronium. Deze niet-depolariserende aminosteroïde neuromusculaire blokker heeft een klein verdelingsvolume en is nagenoeg niet lipofiel. Derhalve kruist het middel onder normale omstandigheden de BHB niet. Rocuronium is echter ook een substraat voor de OATP1A2-transporter. Er zijn verscheidene casussen beschreven waarbij rocuronium het CNS toch bereikt bij patiënten met een verstoorde BHB, waaronder na subarachnoïdale bloeding.Fuchs-Buder T, Strowitzki M, Rentsch K, et al. Concentration of rocuronium in cerebrospinal fluid of patients undergoing cerebral aneurysm clipping. Br J Anaesth 2004; 92(3): 419-21.
Bij epilepsie kan echter ook een upregulatie plaatsvinden van transporters. De gedachte is dat dit ter compensatie is van de continue disruptieve verstoring van de BHB. Mogelijk is dit de oorzaak van therapieresistente epilepsie.Löscher W, Friedman A. Structural, molecular, and functional alterations of the blood‐brain barrier during epileptogenesis and epilepsy: a cause, consequence, or both? Int J Mol Sci 2020; 21(2): 1-19. Anti-epileptica zijn met reden lipofiel gemaakt; hierdoor penetreren zij het CZS goed. Fenytoïne en carbamazepine zijn echter ook substraten voor P-gp, valproïnezuur voor een OATP en lamotrigine voor BRCP. Indien upregulatie plaatsvindt van deze transporters, worden deze middelen versneld geklaard uit het CZS, waardoor hun effectiviteit afneemt. Het toevoegen van verapamil als P-gp-inhibitor leidt mogelijk tot afname van de insultfrequentie. Cyclo-oxygenase-2-remmers (zoals celexocib) leiden ook tot verminderde P-gp-expressie en in rattenmodellen tot vermindering van insulten.
Schade aan de BHB en hiermee aan de verschillende transporters leidt dus meestal tot toegenomen concentraties van het medicament in het CZS. Door deze verstoring kan dit ook optreden bij middelen die normaliter het CZS niet bereiken. De kans op neurotoxiciteit neemt hiermee aanzienlijk toe, ook van middelen waar men niet op bedacht is.
Verschillende strategieën zouden bedacht kunnen worden om hetzij de BHB-verstoring zelf tegen te gaan, hetzij de effecten hiervan te verminderen. Er bestaat momenteel nog geen geschikte therapie die de verstoring van de BHB zelf tegengaat en reeds in de kliniek wordt toegepast. Bij multipele sclerose zijn verschillende anti-inflammatoire middelen onderzocht. Methylprednisolon en interferon gamma zorgen beide voor een reductie van verscheidene MMP’s. Aangezien MMP’s geassocieerd zijn met het verlies van tight junctions, zou dit mogelijk verstoring van de BHB tegengaan.Rempe RG, Hartz AMS, Bauer B. Matrix metalloproteinases in the brain and blood-brain barrier: versatile breakers and makers. J Cereb Blood Flow Metab 2016; 36(9): 1481-507. Daarnaast zouden anti-inflammatoire middelen de lokale cytokinestorm en influx van leukocyten kunnen bestrijden, hoewel deze theorie niet afdoende is onderzocht. Ook het antibioticum minocycline (een tetracycline) heeft een MMP-inhiberend effect. In een gerandomiseerde placebo-gecontroleerde studie bij patiënten met een ischemisch CVA kregen 74 patiënten minocycline voor 5 dagen, en 77 patiënten placebo. De patiëntengroep met minocycline had een significant betere functionele uitkomst op dag 7 en dag 30.Lampl Y, Boaz M, Gilad R, et al. Minocycline treatment in acute stroke. Curr Atheroscler Rep 2008; 10(4): 286-87. Specifieke MMP-inhibitors zijn in ontwikkeling.
Om de effecten van BHB-verstoring tegen te gaan, kan ingegrepen worden op het verminderen van vasogeen of cytotoxisch oedeem, of het verminderen van neuro-inflammatie. VEGF-remmers zoals bevacizumab zouden de ontwikkeling van vasogeen oedeem kunnen verminderen en leiden bij ratten tot afname van de BHB-permeabiliteit. Het lisdiureticum bumetanide is een NKCC1-inhibitor en laat in rattenmodellen zien dat het cytotoxisch oedeem tegengaat.Michinaga S, Koyama Y. Pathogenesis of brain edema and investigation into anti-edema drugs. Int J Mol Sci 2015; 16(5): 9949-75. Gezien de effecten op het serum-natrium wordt dit echter niet toegepast in deze patiëntencategorieën. Glucocorticosteroïden hebben, naast hun anti-inflammatoire effect, ook invloed op VEGF, wat de BHB zou stabiliseren en tot afname van vasogeen oedeem leidt. Sinds de publicatie van de CRASH-1-trial in 2004, waarin een verhoogde mortaliteit gezien werd bij patiënten met neurotrauma die behandeld werden met hoge dosering corticosteroïden ten opzichte van placebo, worden corticosteroïden echter niet meer routinematig gegeven.Olldashi F, Muzha I, Filipi N, et al. Effect of intravenous corticosteroids on death within 14 days in 10.008 adults with clinically significant head injury (MRC CRASH trial): randomised placebo-controlled trial. Lancet 2004; 364(9442): 1321-28.
Gezien de farmacologische consequenties van BHB-verstoring zou beïnvloeding van effluxtransporters wellicht neurotoxiciteit kunnen voorkomen. P-gp-inducers zoals carbamazepine en rifampicine zouden er theoretisch gezien toe kunnen leiden dat de substraten daarvan sneller uit het CZS gehaald worden. Gezien het bijwerkingenprofiel van deze middelen en de zeer beperkte evidence wordt dit echter nog niet toegepast.
De BHB is een van de belangrijkste mechanismen voor regulatie en behoud van cerebrale homeostase en hersenfunctie. Acute ziektebeelden die leiden tot verstoring van de BHB zijn onder andere CVA’s, insulten, systemische inflammatie en neurotraumata. Daarnaast zijn een aantal neurologische ziektebeelden geassocieerd met een chronisch verstoorde BHB, zoals de ziekte van Alzheimer, de ziekte van Parkinson, multipele sclerose en primaire hersentumoren. Bij een verhoogd risico op verstoring van de BHB (het ‘kwetsbare brein’) moet men bedacht zijn op klinische en farmacologische consequenties, zoals cerebraal oedeem, neuro-inflammatie en neurotoxiciteit van verscheidene medicamenten. Hierbij moet ook gedacht worden aan medicamenten die normaliter de BHB niet doorkruisen. Er zijn nog geen klinisch toepasbare behandelingen voor het tegengaan van de verstoring van de BHB of bevordering van herstel.
U heeft geen rechten om het volledige artikel te bekijken of om te reageren.
| Auteurs |
Workum, J.D.
Oldenbeuving, A.W. |
|---|---|
| Thema | Nascholingsartikel |
| Accreditatie | 1 accreditatiepunt |
| Publicatie | 1 maart 2022 |
| Editie | A&I - Jaargang 14 - editie 1 - Editie 1, 2022 |
Na het lezen van dit artikel: